Primera ley de la termodinámica
La primera ley de la termodinámica relaciona el trabajo y el calor
transferido intercambiado en un sistema a través de una nueva variable
termodinámica, la energía interna. Dicha energía ni se crea ni se
destruye, sólo se transforma.
3.1. Trabajo de sistema cerrado, sin fricción y presión uniforme
Trabajo de sistema cerrado
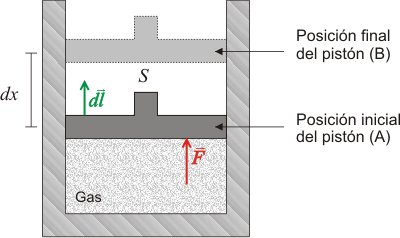
El trabajo es la cantidad de energía transferida de un sistema a otro mediante una fuerza cuando se produce un desplazamiento. Vamos a particularizar la expresión general del trabajo para un sistema termodinámico concreto: un gas encerrado en un recipiente por un pistón, que puede moverse sin rozamiento.
Por efecto de la presión (p) ejercida por el gas, el pistón sufre una fuerza F que lo desplaza desde una posición inicial (A) a una posición final (B), mientras recorre una distancia dx.
A partir de la definición de presión, se puede expresar F y el vector desplazamiento dl en función de un vector unitario u, perpendicular a la superficie de la siguiente forma:
Calculamos el trabajo realizado por el gas desde el estado A al estado B en este proceso:El producto Sdx es la variación de volumen (dV) que ha experimentado el gas, luego finalmente se puede expresar:
En el Sistema Internacional el trabajo se mide en Julios (J).
Este trabajo está considerado desde el punto de vista del sistema termodinámico, por tanto:
El trabajo es positivo cuando lo realiza el gas (expansión) y negativo cuando el exterior lo realiza contra el gas (compresión).
3.2. Trabajo de sistema abierto operando en estado estable, con una entrada y una salida de flujo y sin fricción
|
La masa, como la energía, es una propiedad que se conserva, y no se crea ni se destruye.
E = m c2(la masa cambia al cambiar la energía), excepto en reacciones nucleares, éste cambio es muy pequeño.
Trabajo de sistema abierto
La primera ley de la termodinámica es una generalización de la conservación de la energía en los procesos térmicos.
Se basa en la conclusión de Joule de que el calor y la energía son
equivalentes. Pero para llegar a ella hay que sortear algunas trampas en
el camino.
A partir de la conclusión de Joule
podríamos caer en la tentación de llamar al calor energía «interna»
asociada con la temperatura. Podríamos entonces agregar calor a las
energías potencial y cinética de un sistema, y llamar a esta suma la
energía total, que es lo que conservaría. De hecho, esta solución
funciona bien para una gran variedad de fenómenos, incluyendo los
experimentos de Joule. Los problemas surgen con la idea de «contenido»
de calor de un sistema. Por ejemplo, cuando se calienta un sólido hasta
su punto de fusión, una “entrada de calor” adicional provoca la fusión
pero sin aumentar la temperatura. Con este sencillo experimento vemos
que considerar simplemente la energía térmica medida solo por un aumento de temperatura como parte de la energía total de un sistema no dará una ley general completa.
En lugar de «calor», podemos usar el concepto de energía interna,
esto es, una energía en el sistema que puede tomar formas no
directamente relacionadas con la temperatura. Podemos entonces usar la
palabra «calor» para referirnos solamente a una transferencia de energía
entre un sistema y su entorno. De forma análoga, el término trabajo no
lo utilizaremos para describir algo contenido en el sistema, sino que
describe una transferencia de energía de un sistema a otro. Calor y trabajo son, pues, dos formas en las que la energía se transfiere, no energías.
Estas definiciones no permiten
una declaración simplista como “la entrada de calor a un sistema
aumenta su energía interna, y el trabajo hecho en un sistema aumenta su
energía mecánica”. La entrada de calor a un sistema puede tener efectos
distintos al aumento de la energía interna. En una máquina de vapor, por
ejemplo, la entrada de calor aumenta la energía mecánica del pistón. Del
mismo modo, el trabajo realizado en un sistema puede tener efectos
distintos al aumento de la energía mecánica. Al frotarnos las manos en
un día frío, por ejemplo, el trabajo que hacemos aumenta la energía
interna de la piel de las manos lo que, en este caso, se traduce en un
aumento de la temperatura.
En resumen, una ley
general de conservación de la energía debe incluir la transferencia de
energía como trabajo y la transferencia energía como calor. Además, debe
incluir el cambio en la energía total del sistema, pero no con una parte «mecánica» y una parte «interna».
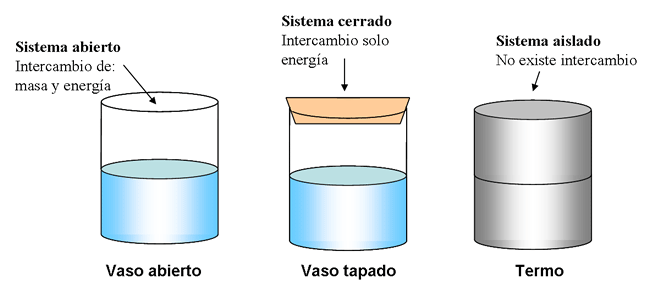
En un sistema aislado, esto es, un sistema que no intercambia materia ni energía con su entorno, la energía total debe permanecer constante. Si el sistema intercambia energía con su entorno, pero no materia (lo que se llama sistema cerrado),
puede hacerlo solo de dos formas: una transferencia de energía bien en
forma de trabajo realizado sobre o por el sistema, bien en forma de
calor hacia o desde el sistema. En el caso de que exista transferencia
de energía, el cambio en la energía del sistema debe ser igual a la
energía neta ganada o perdida por el entorno.
Formalmente*, llamemos W
al trabajo realizado sobre o por el sistema (como el cilindro en una
máquina de vapor). Si el trabajo lo realiza el sistema, diremos que W es negativo; si el trabajo se realiza sobre el sistema, diremos que W es positivo. De forma similar, llamemos ΔQ a la transferencia neta de calor hacia o desde el sistema. Si la transferencia neta de calor es hacia el sistema, ΔQ será positiva; si la transferencia neta sale del sistema, ΔQ será negativa.
Ya lo tenemos todo para enunciar la primera ley de la termodinámica:
La primera ley de la termodinámica establece que el cambio en la energía total de un sistema cerrado, ΔE,
viene dado por la suma del trabajo realizado sobre o por el sistema y
la transferencia neta de calor hacia o desde el sistema. Simbólicamente,
ΔE = W + ΔQ.
Esta expresión general incluye como casos especiales las
versiones preliminares de la ley de conservación de la energía que
hemos dado en entregas anteriores de esta serie. Si no hay transferencia
de calor en absoluto, entonces ΔQ = 0, y ΔE = W.
En este caso, el cambio en la energía de un sistema es igual al trabajo
realizado sobre o por él. Por otra parte, si no se realiza trabajo ni
sobre ni por el sistema, entonces W = 0 y ΔE = ΔQ. En este caso el cambio en la energía del sistema es igual a la transferencia neta de calor.
Esta
ecuación tan sencilla es de una utilidad tremenda. Pero, si bien hemos
enunciado la primera ley, aún queda un misterio por resolver, que es la
estructura de esa energía interna de la que, de momento, solo sabemos
que en algunos casos está relacionada con la temperatura y cómo se
relaciona con la energía total del sistema. Lo veremos más adelante en
esta serie, cuando tengamos la necesidad de introducir el concepto de
átomo. Algo que, hasta ahora, no nos ha hecho falta.
3.3. Trabajo en un proceso cíclico
Decimos que un sistema pasa por un proceso cíclico si el estado del sistema al final es el mismo que el estado al principio. Por lo tanto, las propiedades de estado como temperatura, presión, volumen y energía interna del sistema no cambian a lo largo de un ciclo completo:
ΔEint=0.
Cuando se aplica la primera ley de la termodinámica a un proceso cíclico, se obtiene una relación sencilla entre el calor que entra en el sistema y el trabajo realizado por este a lo largo del ciclo:
Q=W (proceso cíclico).
Los procesos termodinámicos también se distinguen por ser o no reversibles. Un proceso reversible es aquel que se puede hacer para retroceder en la trayectoria mediante cambios diferenciales en el ambiente. Por lo tanto, este proceso debe ser también cuasiestático. Sin embargo, hay que tener en cuenta que un proceso cuasiestático no es necesariamente reversible, ya que pueden intervenir fuerzas disipativas. Por ejemplo, si se produjera una fricción entre el pistón y las paredes del cilindro que contiene el gas, la energía perdida por la fricción nos impediría reproducir los estados originales del sistema.
Consideramos varios procesos termodinámicos:
- Un proceso isotérmico, durante el cual la temperatura del sistema permanece constante.
- Un proceso adiabático, durante el cual no se transfiere calor hacia ni desde el sistema.
- Un proceso isobárico, durante el cual la presión del sistema no cambia.
- Un proceso isocórico, durante el cual el volumen del sistema no cambia
También se producen muchos otros procesos que no encajan en ninguna de estas cuatro categorías.
3.4. Calor y proceso adiabático
En un proceso adiabático el sistema está aislado de su ambiente de modo que, aunque el estado del sistema cambia, no se permite que el calor entre o salga del sistema. Un proceso adiabático se puede llevar a cabo de forma cuasiestática o no cuasiestática. Cuando un sistema se expande adiabáticamente, debe realizar un trabajo contra el mundo exterior y, por tanto, su energía disminuye, lo que se refleja en el descenso de la temperatura del sistema. Una expansión adiabática conduce a una disminución de temperatura, y una compresión adiabática conduce a un aumento de temperatura. Volvemos a hablar de la expansión adiabática en la sección Procesos adiabáticos para un gas ideal.
Se libera un pistón aislado con un gas caliente y comprimido. El pistón se mueve hacia arriba, el volumen se expande y la presión y la temperatura disminuyen. La energía interna va al trabajo. Si la expansión se produce en un tiempo en el que el calor puede entrar en el sistema de forma insignificante, el proceso se denomina adiabático. Idealmente, durante un proceso adiabático no entra ni sale calor del sistema.
3.5. Sistema con transferencia de calor
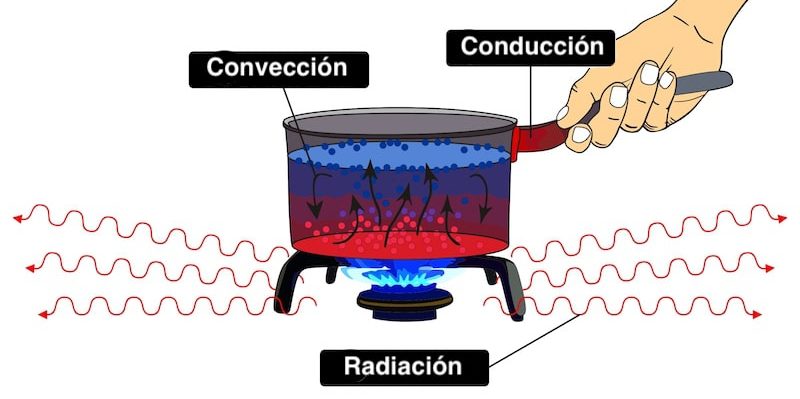
Se denomina transferencia de calor, transferencia térmica o transmisión de calor al fenómeno físico que consiste en el traspaso de energía calórica de un medio a otro.
Esto ocurre cuando dos sistemas que se encuentran a distintas temperaturas se ponen en contacto, permitiendo el flujo de la energía del punto de mayor temperatura al de menor, hasta alcanzar un equilibrio térmico, en el que se igualan las temperaturas.
El proceso de la transferencia de calor es indetenible (no se lo puede frenar) aunque ralentizable (se puede desacelerar), empleando barrares y aislantes. Pero siempre que exista una diferencia de calor en el universo, el calor tenderá a transferirse a través de los medios disponibles. Dependiendo de ellos, dicha transferencia podrá darse por tres modos: conducción, convección y radiación.
Conducción
Se llama conducción a la transferencia de calor mediante el contacto directo de las partículas de un material con las de otro, sin transferir materia entre los cuerpos. Ocurre en todos los estados de agregación: sólido, líquido o gaseoso, aunque en estos dos últimos suele preferirse la convección.
La cantidad de calor que se transfiere mediante la conducción está determinada por la Ley de Fourier, según la cual la velocidad de transferencia del calor a través de un cuerpo es proporcional al gradiente de temperatura que existe en él.
Convección
La convección es semejante a la conducción, excepto que ocurre en los casos en que un fluido recibe calor y se mueve para transmitirlo dentro de un espacio donde está contenido. La convección es el transporte de calor por medio del movimiento de un fluido, sea gaseoso o líquido.
Dicha transferencia se da en los términos planteados por la Ley del enfriamiento de Newton, que establece que un cuerpo pierde su calor a un ritmo proporcional a la diferencia de temperatura entre el cuerpo y sus alrededores.
Un claro ejemplo de ello ocurre cuando calentamos agua en un recipiente. El calor transferido por conducción del recipiente al líquido calentará las porciones que estén en contacto directo con él, que ascenderán y forzarán a otras porciones frías del líquido a ocupar su lugar, calentándose así uniformemente el agua.
Radiación
El último tipo de transferencia de calor es también el único que puede darse en ausencia de contacto y, por ende, también de un medio físico, o sea, en el vacío.
Esto se debe a que su origen está en el movimiento térmico de las partículas cargadas de la materia, que desencadena la emisión de partículas electromagnéticas, es decir, de radiación térmica, siendo su intensidad dependiente de su temperatura y la longitud de onda de la radiación considerada.
Generalmente, los cuerpos en esta situación emiten radiación ultravioleta, pero a partir de ciertas temperaturas pueden emitir radiación en el espectro visible, o sea, luz. La cantidad de calor irradiada de esta manera puede determinarse por la Ley de Stefan-Boltzmann.
A diario observamos el mejor ejemplo de radiación térmica: el Sol. A pesar de hallarse a 149,6 millones de kilómetros de nuestro planeta, la temperatura del Sol es tan alta que irradia hacia el espacio enormes cantidades de luz y de calor.
Ambas cosas alcanzan la superficie terrestre y la mantienen caliente e iluminada, con longitudes de onda que van desde el ultravioleta hasta el infrarrojo, pasando obviamente por todo el espectro visible.
3.6. Primera ley de la termodinámica en
La Termodinámica es la rama de la Física que estudia a nivel macroscópico las transformaciones de la energía, y cómo esta energía puede convertirse en trabajo (movimiento). Históricamente, la Termodinámica nació en el siglo XIX de la necesidad de mejorar el rendimiento de las primeras máquinas térmicas fabricadas por el hombre durante la Revolución Industrial.
La Termodinámica clásica (que es la que se tratará en estas páginas) se desarrolló antes de que la estructura atómica fuera descubierta (a finales del siglo XIX), por lo que los resultados que arroja y los principios que trata son independientes de la estructura atómica y molecular de la materia.
El punto de partida de la mayor parte de consideraciones termodinámicas es las llamadas leyes o principios de la Termodinámica. En términos sencillos, estas leyes definen cómo tienen lugar las transformaciones de energía. Con el tiempo, han llegado a ser de las leyes más importantes de la ciencia.
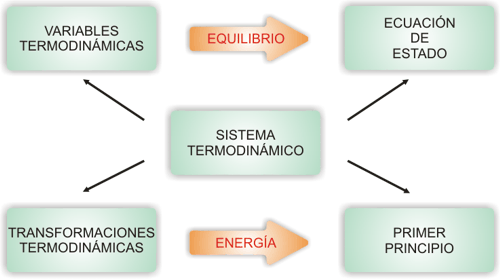
Antes de entrar en el estudio de los principios de la termodinámica, es necesario introducir algunas nociones preliminares, como qué es un sistema termodinámico, cómo se describe, qué tipo de transformaciones puede experimentar, etc. Estos conceptos están resumidos en el siguiente cuadro:
3.6.2. Sistema cerrado
Un sistema cerrado o masa de control es un sistema en el que la
masa no atraviesa la frontera del mismo. Se permite que la
energía cruce las fronteras del sistema y que la sustancia cambie
su composición química mientras permanezca dentro de las
fronteras.- Un ejemplo de sistema cerrado son las ollas a presión, porque permiten un intercambio de energía, pero no de masa. Los alimentos que se cocinan dentro de la olla reciben energía calorífica, pero no varían su masa.
- Otro ejemplo importante de este tipo de sistemas es el motor de Stirling. Esta máquina térmica intercambia energía térmica con sus alrededores y la convierte en energía mecánica, pero sin intercambiar masa.
Dado que es muy difícil tener un sistema perfectamente aislado, se utilizan los sistemas cerrados como aproximación para describir a los sistemas aislados. Es por esto que el estudio de estos sistemas es fundamental para la termodinámica:
- La primera ley de la termodinámica para los sistemas cerrados afirma que el cambio en la energía interna es igual a la suma del trabajo y el calor añadidos al sistema.
- La segunda ley de la termodinámica establece que la entropía de un sistema cerrado aumenta con el calor absorbido y el trabajo realizado por el sistema.
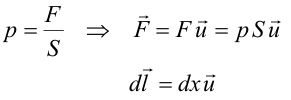
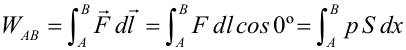
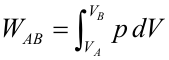



Comentarios
Publicar un comentario